రచయిత:
Sara Rhodes
సృష్టి తేదీ:
12 ఫిబ్రవరి 2021
నవీకరణ తేదీ:
24 జూన్ 2024

విషయము
- దశలు
- 3 లో 1 వ పద్ధతి: పిహెచ్ అంటే ఏమిటి
- పద్ధతి 2 లో 3: తెలిసిన ఏకాగ్రత నుండి pH ని లెక్కించండి
- పద్ధతి 3 లో 3: తెలిసిన pH నుండి ఏకాగ్రతను లెక్కించండి
- చిట్కాలు
రోజువారీ జీవితంలో, pH సాధారణంగా తటస్థతను వివరించడానికి ఉపయోగించే స్కేల్గా అర్థం అవుతుంది లేదా దీనికి విరుద్ధంగా, పదార్ధం యొక్క తటస్థత లేకపోవడం. శాస్త్రీయ పరంగా, pH విలువ రసాయన ద్రావణంలో అయాన్ల మొత్తానికి అనుగుణంగా ఉంటుంది. మీరు కెమిస్ట్రీ లేదా సంబంధిత సబ్జెక్టులను చదువుతుంటే, ద్రావణంలో పదార్థాల ఏకాగ్రత ఆధారంగా మీరు pH స్థాయిని లెక్కించాల్సి ఉంటుంది. కింది సూత్రాన్ని ఉపయోగించి pH విలువ కనుగొనబడింది: pH = -lg [H3ఓ].
దశలు
3 లో 1 వ పద్ధతి: పిహెచ్ అంటే ఏమిటి
 1 PH గురించి తెలుసుకోండి. పిహెచ్ విలువ ద్రావణంలో హైడ్రోజన్ అయాన్ల సాంద్రతకు అనుగుణంగా ఉంటుంది. హైడ్రోజన్ అయాన్ల సాంద్రత పెరిగిన ద్రావణాన్ని ఆమ్ల అని అంటారు మరియు ఈ అయాన్ల సాంద్రత తగ్గిన ద్రావణాన్ని ఆల్కలీన్ అంటారు. హైడ్రోజన్ అయాన్లు క్లుప్తంగా హెచ్.30.
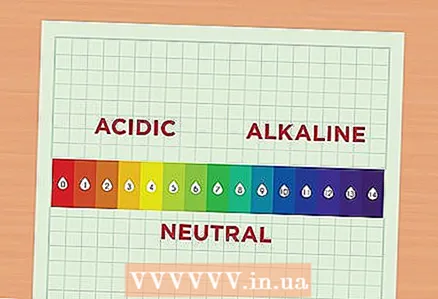
1 PH గురించి తెలుసుకోండి. పిహెచ్ విలువ ద్రావణంలో హైడ్రోజన్ అయాన్ల సాంద్రతకు అనుగుణంగా ఉంటుంది. హైడ్రోజన్ అయాన్ల సాంద్రత పెరిగిన ద్రావణాన్ని ఆమ్ల అని అంటారు మరియు ఈ అయాన్ల సాంద్రత తగ్గిన ద్రావణాన్ని ఆల్కలీన్ అంటారు. హైడ్రోజన్ అయాన్లు క్లుప్తంగా హెచ్.30. - పిహెచ్ స్కేల్ చదవండి. పిహెచ్ స్కేల్ 1 నుండి 14 వరకు ఉంటుంది. తక్కువ సంఖ్య, మరింత ఆమ్ల పరిష్కారం. దీనికి విరుద్ధంగా, అధిక విలువ, మరింత ఆల్కలీన్ పరిష్కారం. ఉదాహరణకు, నారింజ రసం యొక్క pH 2 ఎందుకంటే ఈ రసం చాలా ఆమ్ల ద్రవం. క్లోరిన్ బ్లీచ్లో pH 12 ఉంటుంది ఎందుకంటే ఇందులో చాలా క్షారాలు ఉంటాయి. స్కేల్ మధ్యలో pH 7 ఉన్న నీరు వంటి సాపేక్షంగా తటస్థ పరిష్కారాలు ఉన్నాయి.
- పిహెచ్ స్కేల్పై రెండు పరిష్కారాల మధ్య 1-పాయింట్ వ్యత్యాసం అంటే అవి 10 కారకం ద్వారా ఆమ్లత్వంతో విభేదిస్తాయి. ఉదాహరణకు, మీరు pH 6 మరియు 7 తో రెండు పరిష్కారాలను తీసుకుంటే, pH 6 తో మొదటి ద్రావణం యొక్క ఆమ్లత్వం pH 7 తో రెండవ ద్రావణం యొక్క ఆమ్లత్వం కంటే 10 రెట్లు ఎక్కువగా ఉంటుంది. మరియు, ఉదాహరణకు, pH 6 తో ఉన్న ద్రావణం యొక్క ఆమ్లత్వం 8 pH ఉన్న ద్రావణం యొక్క ఆమ్లత్వం కంటే 100 రెట్లు ఎక్కువ.
 2 PH ని నిర్ణయించడానికి సమీకరణాన్ని గుర్తుంచుకోండి. ప్రతికూల దశాంశ లాగరిథమ్ ఉపయోగించి pH స్కేల్ లెక్కించబడుతుంది. ఒక ప్రతికూల దశాంశ లాగరిథమ్ సున్నా పూర్ణాంకాలతో సహా ఒకదాని ముందు ఉన్న సున్నాల సంఖ్యకు అనుగుణంగా ఉంటుంది: ఉదాహరణకు, 0.1 యొక్క ప్రతికూల దశాంశ లాగరిథమ్ 1, 0.01 2, మొదలైనవి. PH ను కనుగొనడానికి సూత్రం క్రింది విధంగా ఉంది: pH = -lg [H3ఓ].
2 PH ని నిర్ణయించడానికి సమీకరణాన్ని గుర్తుంచుకోండి. ప్రతికూల దశాంశ లాగరిథమ్ ఉపయోగించి pH స్కేల్ లెక్కించబడుతుంది. ఒక ప్రతికూల దశాంశ లాగరిథమ్ సున్నా పూర్ణాంకాలతో సహా ఒకదాని ముందు ఉన్న సున్నాల సంఖ్యకు అనుగుణంగా ఉంటుంది: ఉదాహరణకు, 0.1 యొక్క ప్రతికూల దశాంశ లాగరిథమ్ 1, 0.01 2, మొదలైనవి. PH ను కనుగొనడానికి సూత్రం క్రింది విధంగా ఉంది: pH = -lg [H3ఓ]. - కొన్నిసార్లు ఫార్ములా pH = -lg [H] గా వ్రాయబడుతుంది. H సమీకరణం అయితే ఫర్వాలేదు3O లేదా H, రెండూ సమానమైనవి.
- దాదాపు ప్రతి శాస్త్రీయ లేదా ఇంజనీరింగ్ కాలిక్యులేటర్ దానిని లెక్కించడానికి ఒక ఎంపికను కలిగి ఉన్నందున, pH ను కనుగొనడానికి దశాంశ లాగరిథమ్ను లెక్కించడం అవసరం లేదు.
 3 ఏకాగ్రత గురించి తెలుసుకోండి. ఒక పదార్ధం యొక్క ఏకాగ్రత ద్రావణంలో ఉన్న ఈ పదార్ధం యొక్క కణాల సంఖ్యకు అనుగుణంగా ఉంటుంది. నియమం ప్రకారం, ఏకాగ్రత యూనిట్ వాల్యూమ్లోని మోల్స్ సంఖ్యలో వ్యక్తీకరించబడుతుంది మరియు m / V లేదా M. గా సూచించబడుతుంది రసాయన ప్రయోగశాలలలో, వాటితో బాటిళ్లపై పరిష్కారాల ఏకాగ్రత వ్రాయబడుతుంది. మీరు ఒక రసాయన సమస్యను పరిష్కరిస్తుంటే, ఏకాగ్రత స్థితిలో ఇవ్వబడుతుంది, లేదా అది తప్పక కనుగొనబడుతుంది.
3 ఏకాగ్రత గురించి తెలుసుకోండి. ఒక పదార్ధం యొక్క ఏకాగ్రత ద్రావణంలో ఉన్న ఈ పదార్ధం యొక్క కణాల సంఖ్యకు అనుగుణంగా ఉంటుంది. నియమం ప్రకారం, ఏకాగ్రత యూనిట్ వాల్యూమ్లోని మోల్స్ సంఖ్యలో వ్యక్తీకరించబడుతుంది మరియు m / V లేదా M. గా సూచించబడుతుంది రసాయన ప్రయోగశాలలలో, వాటితో బాటిళ్లపై పరిష్కారాల ఏకాగ్రత వ్రాయబడుతుంది. మీరు ఒక రసాయన సమస్యను పరిష్కరిస్తుంటే, ఏకాగ్రత స్థితిలో ఇవ్వబడుతుంది, లేదా అది తప్పక కనుగొనబడుతుంది.
పద్ధతి 2 లో 3: తెలిసిన ఏకాగ్రత నుండి pH ని లెక్కించండి
 1 PH ను కనుగొనడానికి సూత్రాన్ని గుర్తుంచుకోండి. ఇక్కడ ఫార్ములా ఉంది: pH = -lg [H3ఓ]. ఈ సూత్రాన్ని రూపొందించే అన్ని అంశాల గురించి మీకు తెలిసినట్లు నిర్ధారించుకోండి. ఏ విలువ ఏకాగ్రతకు అనుగుణంగా ఉందో చూడండి.
1 PH ను కనుగొనడానికి సూత్రాన్ని గుర్తుంచుకోండి. ఇక్కడ ఫార్ములా ఉంది: pH = -lg [H3ఓ]. ఈ సూత్రాన్ని రూపొందించే అన్ని అంశాల గురించి మీకు తెలిసినట్లు నిర్ధారించుకోండి. ఏ విలువ ఏకాగ్రతకు అనుగుణంగా ఉందో చూడండి. - రసాయన శాస్త్రంలో, చదరపు బ్రాకెట్లు అంటే ఏకాగ్రత.కాబట్టి pH లెక్కించడానికి సూత్రం "pH అనేది హైడ్రోనియం అయాన్ గాఢత యొక్క ప్రతికూల లాగరిథమ్కి సమానం."
 2 అసలు ఏకాగ్రతను నిర్ణయించండి. సమస్య ప్రకటనను జాగ్రత్తగా చదవండి. మూలం డేటాలో యాసిడ్ లేదా క్షార సాంద్రతను కనుగొనండి. కాగితంపై పూర్తి సూత్రాన్ని వ్రాయండి, తెలిసిన విలువలను దానిలో ప్రత్యామ్నాయం చేయండి. గందరగోళాన్ని నివారించడానికి, ఎల్లప్పుడూ సంఖ్యల పక్కన కొలత యూనిట్లను సూచించండి.
2 అసలు ఏకాగ్రతను నిర్ణయించండి. సమస్య ప్రకటనను జాగ్రత్తగా చదవండి. మూలం డేటాలో యాసిడ్ లేదా క్షార సాంద్రతను కనుగొనండి. కాగితంపై పూర్తి సూత్రాన్ని వ్రాయండి, తెలిసిన విలువలను దానిలో ప్రత్యామ్నాయం చేయండి. గందరగోళాన్ని నివారించడానికి, ఎల్లప్పుడూ సంఖ్యల పక్కన కొలత యూనిట్లను సూచించండి. - ఉదాహరణకు, ఏకాగ్రత 1.05 x 10 M అయితే, pH ను లెక్కించడానికి సూత్రాన్ని క్రింది విధంగా వ్రాయండి: pH = -lg [1.05 x 10 M]
 3 PH లెక్కించండి. దీని కోసం శాస్త్రీయ కాలిక్యులేటర్ని ఉపయోగించడం సౌకర్యంగా ఉంటుంది. ముందుగా "+/-" బటన్ను నొక్కడం ద్వారా మైనస్ గుర్తును నమోదు చేయండి. అప్పుడు దశాంశ లాగరిథమ్కు సంబంధించిన “లాగ్” బటన్ను నొక్కండి (ఆంగ్లంలో, దశాంశ లాగరిథమ్ లాగ్గా సూచిస్తారు). స్క్రీన్ "-log" ని ప్రదర్శిస్తుంది. అప్పుడు ఎడమ బ్రాకెట్ను నొక్కండి మరియు ఏకాగ్రతను నమోదు చేయండి. అవసరమైతే డిగ్రీ విలువను సూచించడం మర్చిపోవద్దు. అప్పుడు బ్రాకెట్లను మూసివేయండి. ఫలితంగా, మీరు కాలిక్యులేటర్ స్క్రీన్లో “-log (1.05x10) చూస్తారు. "=" క్లిక్ చేయండి. మీరు దాదాపు 4.98 pH విలువ కలిగి ఉండాలి.
3 PH లెక్కించండి. దీని కోసం శాస్త్రీయ కాలిక్యులేటర్ని ఉపయోగించడం సౌకర్యంగా ఉంటుంది. ముందుగా "+/-" బటన్ను నొక్కడం ద్వారా మైనస్ గుర్తును నమోదు చేయండి. అప్పుడు దశాంశ లాగరిథమ్కు సంబంధించిన “లాగ్” బటన్ను నొక్కండి (ఆంగ్లంలో, దశాంశ లాగరిథమ్ లాగ్గా సూచిస్తారు). స్క్రీన్ "-log" ని ప్రదర్శిస్తుంది. అప్పుడు ఎడమ బ్రాకెట్ను నొక్కండి మరియు ఏకాగ్రతను నమోదు చేయండి. అవసరమైతే డిగ్రీ విలువను సూచించడం మర్చిపోవద్దు. అప్పుడు బ్రాకెట్లను మూసివేయండి. ఫలితంగా, మీరు కాలిక్యులేటర్ స్క్రీన్లో “-log (1.05x10) చూస్తారు. "=" క్లిక్ చేయండి. మీరు దాదాపు 4.98 pH విలువ కలిగి ఉండాలి.
పద్ధతి 3 లో 3: తెలిసిన pH నుండి ఏకాగ్రతను లెక్కించండి
 1 ఏమి ఇవ్వబడింది మరియు మీరు ఏమి కనుగొనాలనుకుంటున్నారో నిర్ణయించండి. PH లెక్కించడానికి సూత్రాన్ని వ్రాయండి. ఫార్ములా కింద వాటి విలువలను వ్రాయడం ద్వారా తెలిసిన విలువలను గుర్తించండి. ఉదాహరణకు, మీ pH 10.1 అని మీకు తెలిస్తే, ఆ సంఖ్యను మీ ఫార్ములాలో pH కింద రాయండి.
1 ఏమి ఇవ్వబడింది మరియు మీరు ఏమి కనుగొనాలనుకుంటున్నారో నిర్ణయించండి. PH లెక్కించడానికి సూత్రాన్ని వ్రాయండి. ఫార్ములా కింద వాటి విలువలను వ్రాయడం ద్వారా తెలిసిన విలువలను గుర్తించండి. ఉదాహరణకు, మీ pH 10.1 అని మీకు తెలిస్తే, ఆ సంఖ్యను మీ ఫార్ములాలో pH కింద రాయండి.  2 ఫార్ములాను మార్చండి. ఈ సందర్భంలో, మీకు స్కూల్ ఆల్జీబ్రా కోర్సు నుండి జ్ఞానం అవసరం. తెలిసిన pH విలువ నుండి ఏకాగ్రతను లెక్కించడానికి, సమీకరణానికి ఇరువైపులా ఏకాగ్రత వేరుగా ఉండేలా సూత్రాన్ని మార్చడం అవసరం. అంటే, సమాన సంకేతం యొక్క ఒక వైపు pH విలువను కలిగి ఉన్న వ్యక్తీకరణ మరియు మరొక వైపు - హైడ్రోనియం గాఢత అవసరం. ముందుగా, సమీకరణం యొక్క రెండు వైపులా -1 ద్వారా గుణించండి. ఫలిత సమానత్వానికి ఇరువైపులా ఉన్న అధికారాలకు 10 ని పెంచండి.
2 ఫార్ములాను మార్చండి. ఈ సందర్భంలో, మీకు స్కూల్ ఆల్జీబ్రా కోర్సు నుండి జ్ఞానం అవసరం. తెలిసిన pH విలువ నుండి ఏకాగ్రతను లెక్కించడానికి, సమీకరణానికి ఇరువైపులా ఏకాగ్రత వేరుగా ఉండేలా సూత్రాన్ని మార్చడం అవసరం. అంటే, సమాన సంకేతం యొక్క ఒక వైపు pH విలువను కలిగి ఉన్న వ్యక్తీకరణ మరియు మరొక వైపు - హైడ్రోనియం గాఢత అవసరం. ముందుగా, సమీకరణం యొక్క రెండు వైపులా -1 ద్వారా గుణించండి. ఫలిత సమానత్వానికి ఇరువైపులా ఉన్న అధికారాలకు 10 ని పెంచండి. - సమానత్వం pH = -log [H3O], మేము ఫార్ములా + [H3O] = 10, అంటే, అయాన్ ఏకాగ్రత -pH శక్తికి పది. ఇప్పుడు, pH కి బదులుగా, మేము తెలిసిన విలువను ప్రత్యామ్నాయం చేస్తాము, మా విషయంలో 10.1.
 3 సమీకరణాన్ని పరిష్కరించండి. కాలిక్యులేటర్లో పదిని పవర్కు పెంచడానికి ఒక నిర్దిష్ట విధానం ఉంది. మొదట టైప్ చేయండి 10. తర్వాత ఘాతాంకం కీని నొక్కండి. మైనస్ గుర్తు మరియు డిగ్రీ విలువను నమోదు చేయండి. "=" క్లిక్ చేయండి.
3 సమీకరణాన్ని పరిష్కరించండి. కాలిక్యులేటర్లో పదిని పవర్కు పెంచడానికి ఒక నిర్దిష్ట విధానం ఉంది. మొదట టైప్ చేయండి 10. తర్వాత ఘాతాంకం కీని నొక్కండి. మైనస్ గుర్తు మరియు డిగ్రీ విలువను నమోదు చేయండి. "=" క్లిక్ చేయండి. - మా ఉదాహరణలో, pH 10.1. "10" డయల్ చేయండి మరియు "EXP" కీని నొక్కండి. అప్పుడు గుర్తును మారుస్తూ "- / +" నొక్కండి. చివరగా, pH విలువ "10.1" నమోదు చేసి, "=" కీని నొక్కండి. ఫలితంగా, మీరు 1e-100 తో ముగించాలి. దీని అర్థం ఏకాగ్రత 1.00 x 10 M.
 4 మీరు అందుకున్న సమాధానాన్ని పరిగణించండి. ఇది భౌతిక అర్ధాన్ని కలిగిస్తుందా? పిహెచ్ 10.1 అయితే, హైడ్రోనియం సాంద్రత చాలా తక్కువగా ఉందని మరియు మీకు ఆల్కలీన్ ద్రావణం ఉందని అర్థం. అందువలన, కనుగొనబడిన చాలా తక్కువ ఏకాగ్రత అనుగుణంగా ఉంటుంది
4 మీరు అందుకున్న సమాధానాన్ని పరిగణించండి. ఇది భౌతిక అర్ధాన్ని కలిగిస్తుందా? పిహెచ్ 10.1 అయితే, హైడ్రోనియం సాంద్రత చాలా తక్కువగా ఉందని మరియు మీకు ఆల్కలీన్ ద్రావణం ఉందని అర్థం. అందువలన, కనుగొనబడిన చాలా తక్కువ ఏకాగ్రత అనుగుణంగా ఉంటుంది
చిట్కాలు
- మీ pH స్థాయిని లెక్కించడం మొదట కష్టంగా ఉంటే, విషయం గురించి మరింత తెలుసుకోవడానికి అనేక వనరులు ఉన్నాయని గుర్తుంచుకోండి. కెమిస్ట్రీ పాఠ్యపుస్తకాన్ని ఉపయోగించండి లేదా మీకు సహాయం చేయమని ఉపాధ్యాయుడిని అడగండి.