రచయిత:
Louise Ward
సృష్టి తేదీ:
11 ఫిబ్రవరి 2021
నవీకరణ తేదీ:
1 జూలై 2024

విషయము
ఒక అణువు యొక్క పరిమాణం చాలా చిన్నది, రసాయన సమ్మేళనం యొక్క పరమాణు సంఖ్యను ఖచ్చితంగా కొలవడం కష్టం. పదార్ధం యొక్క ఖచ్చితమైన మొత్తాన్ని కొలవడానికి, శాస్త్రవేత్తలు నిర్దిష్ట సంఖ్యలో అణువులను సూచించడానికి మోల్ యొక్క యూనిట్ను ఉపయోగిస్తారు. పదార్ధం యొక్క ఒక మోల్ 12 కార్బన్ ఐసోటోప్ యొక్క 12 గ్రాములలో ఉన్న కార్బన్ అణువుల సంఖ్యకు సమానం అని నిర్వచించబడింది, ఇది సుమారు 6,022 x 10 అణువులు. ఈ విలువను అవోగాడ్రో సంఖ్య లేదా అవోగాడ్రో స్థిరాంకం అంటారు. దీనిని ఏదైనా మూలకం యొక్క 1 మోల్లోని అణువుల సంఖ్యగా కూడా సూచిస్తారు, మరియు ఒక పదార్ధం యొక్క ద్రవ్యరాశి యొక్క 1 మోల్ను ఆ పదార్ధం యొక్క మోలార్ ద్రవ్యరాశి అంటారు.
దశలు
2 యొక్క పద్ధతి 1: ఒక మూలకం యొక్క మోలార్ ద్రవ్యరాశిని లెక్కించండి
మోలార్ ద్రవ్యరాశి యొక్క నిర్వచనం. ఒక పదార్ధం యొక్క మోలార్ ద్రవ్యరాశి ఆ పదార్ధం యొక్క ఒక మోల్ యొక్క ద్రవ్యరాశి (గ్రాములలో). ఒక మూలకం యొక్క మోలార్ ద్రవ్యరాశిని లెక్కించడానికి, దాని పరమాణు ద్రవ్యరాశిని గ్రామ్-పర్-మోల్ మార్పిడి కారకం (g / mol) ద్వారా గుణించండి.
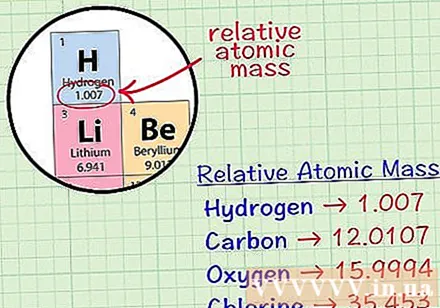
ఒక మూలకం యొక్క సగటు క్యూబిక్ అణువును కనుగొనండి. ఒక మూలకం యొక్క సగటు ద్రవ్యరాశి అణువు అణు యూనిట్లలో, ఆ మూలకం యొక్క అన్ని ఐసోటోపులను కలిగి ఉన్న ఒక నమూనాలో సగటు ద్రవ్యరాశి. ఈ సమాచారం తరచూ మూలకాల ఆవర్తన పట్టికలో ఇవ్వబడుతుంది. ఒక మూలకాన్ని గుర్తించడం ద్వారా, మూలకం యొక్క రసాయన చిహ్నం క్రింద వ్రాసిన సగటు క్యూబిక్ అణువును మీరు కనుగొనవచ్చు. ఈ విలువ పూర్ణాంకం కాదు, దశాంశాలతో కూడిన సంఖ్య.- ఉదాహరణకు, హైడ్రోజన్తో, సగటు ద్రవ్యరాశి అణువు 1.007; కార్బన్ యొక్క సగటు క్యూబిక్ అణువు 12,0107; ఆక్సిజన్ యొక్క సగటు ద్రవ్యరాశి అణువు 15,9994; క్లోరిన్ సగటు అణు ద్రవ్యరాశి 35,453.

సగటు ద్రవ్యరాశి అణువును మోలార్ ద్రవ్యరాశి స్థిరాంకం ద్వారా గుణించండి. మోలార్ గ్లైడ్ యొక్క యూనిట్ మోల్కు 0.001 కిలోగ్రాములు లేదా మోల్కు 1 గ్రాములుగా నిర్వచించబడింది. సగటు ద్రవ్యరాశి అణువు యొక్క ఉత్పత్తి మరియు మోలార్ ద్రవ్యరాశి స్థిరాంకం అణు ద్రవ్యరాశి యొక్క యూనిట్ను మోల్కు గ్రాములుగా మారుస్తుంది, కాబట్టి హైడ్రోజన్ యొక్క మోలార్ ద్రవ్యరాశి మోల్కు 1.007 గ్రాములు అవుతుంది, ఎందుకంటే కార్బన్ 12. , మోల్కు 0107 గ్రాములు, ఆక్సిజన్ మోల్కు 15,9995 గ్రాములు, క్లోరిన్ మోల్కు 35,453 గ్రాములు.- రెండు లేదా అంతకంటే ఎక్కువ అణువులను కలిగి ఉన్న అణువులుగా కొన్ని అంశాలు ప్రకృతిలో ఉన్నాయి. అంటే, మీరు హైడ్రోజన్ వాయువు, ఆక్సిజన్ వాయువు లేదా క్లోరిన్ వాయువు వంటి ఒకటి కంటే ఎక్కువ అణువులతో తయారైన సమ్మేళనాల మోలార్ ద్రవ్యరాశిని లెక్కించాలనుకుంటే, మీరు సమ్మేళనం యొక్క సగటు పరమాణు ద్రవ్యరాశిని నిర్ణయించి ఈ విలువను గుణించాలి. మోలార్ మాస్ స్థిరాంకంతో, '' ఆపై '' మీరు కనుగొన్న ఉత్పత్తిని 2 ద్వారా గుణించండి.
- H తో2: ఒక మోల్కు 1,007 x 2 = 2,014 గ్రాములు; O కోసం2: ఒక మోల్కు 15,9994 x 2 = 31,9988 గ్రాములు; మరియు Cl2: మోల్కు 35,453 x 2 = 70,096 గ్రాములు.
2 యొక్క 2 విధానం: సమ్మేళనం యొక్క మోలార్ ద్రవ్యరాశిని లెక్కించండి

సమ్మేళనం యొక్క నిర్మాణ సూత్రాన్ని నిర్ణయించండి. పదార్ధం యొక్క నిర్మాణ సూత్రం ఆ సమ్మేళనాన్ని తయారుచేసే ప్రతి మూలకం యొక్క పరమాణు సంఖ్యను ఇస్తుంది. (ఈ సమాచారం అన్ని రిఫరెన్స్ పుస్తకాలలో లభిస్తుంది). ఉదాహరణకు, హైడ్రోక్లోరిక్ ఆమ్లం యొక్క రసాయన సూత్రం HCl; గ్లూకోజ్ యొక్క సి6హెచ్12ఓ6. ఈ నిర్మాణాత్మక సూత్రంతో, పరిశీలనలో ఉన్న సమ్మేళనాన్ని కలిగి ఉన్న ప్రతి రకం అణువుల సంఖ్యను మనం నిర్ణయించవచ్చు.- ఇక్కడ హెచ్సిఎల్కు ఒక హైడ్రోజన్ అణువు మరియు ఒక క్లోరిన్ అణువు ఉన్నాయి.
- గ్లూకోజ్ చక్కెర అణువు సి6హెచ్12ఓ6 6 కార్బన్ అణువులు, 12 హైడ్రోజన్ అణువులు మరియు 6 ఆక్సిజన్ అణువులను కలిగి ఉంది.
ప్రతి భాగం మూలకం యొక్క సగటు ద్రవ్యరాశి అణువును నిర్ణయించండి. సమ్మేళనం ఉన్న ప్రతి మూలకం యొక్క సగటు ద్రవ్యరాశి అణువును కనుగొనడానికి ఆవర్తన పట్టికను ఉపయోగించండి. సగటు ద్రవ్యరాశి అణువు సాధారణంగా ఆవర్తన పట్టికలోని మూలకం యొక్క రసాయన చిహ్నం క్రింద వ్రాయబడుతుంది. ఒక మూలకం యొక్క మోలార్ ద్రవ్యరాశిని లెక్కించడం మాదిరిగానే, సగటు ద్రవ్యరాశి అణువును 1 గ్రాము / మోల్ ద్వారా గుణించండి.
- హైడ్రోక్లోరిక్ ఆమ్లాన్ని తయారుచేసే మూలకాల సగటు ద్రవ్యరాశి అణువు క్రింది విధంగా ఉంటుంది: హైడ్రోజన్ 1,007 గ్రా / మోల్ మరియు క్లోరిన్ 35,453 గ్రా / మోల్.
- గ్లూకోజ్ అణువును తయారుచేసే మూలకాల సగటు ద్రవ్యరాశి అణువు: కార్బన్, 12,017 గ్రా / మోల్; హైడ్రోజన్, 1,007 గ్రా / మోల్; మరియు ఆక్సిజన్, 15.9995 గ్రా / మోల్.
ప్రతి భాగం మూలకం యొక్క మోలార్ ద్రవ్యరాశిని లెక్కించండి. ఒక మూలకం యొక్క ద్రవ్యరాశి అణువును సమ్మేళనంలో దోహదం చేసే అణువుల సంఖ్యతో గుణించడం సమ్మేళనం లోని మూలకం యొక్క సగటు ద్రవ్యరాశిని ఇస్తుంది.
- హైడ్రోక్లోరిక్ ఆమ్లం, హెచ్సిఎల్ విషయంలో, హైడ్రోజన్ మూలకం యొక్క మోలార్ ద్రవ్యరాశి 1,007 గ్రా / మోల్, మరియు క్లోరిన్ 35,453 గ్రా / మోల్.
- గ్లూకోజ్ విషయంలో, సి6హెచ్12ఓ6, ప్రతి మూలకం యొక్క మోలార్ ద్రవ్యరాశి క్రింది విధంగా ఉంటుంది: కార్బన్, 12,0107 x 6 = 72,0642 గ్రా / మోల్; హైడ్రోజన్, 1,007 x 12 = 12,084 గ్రా / మోల్; ఆక్సిజన్, 15,9995 x 6 = 95,9964 గ్రా / మోల్.
రాజ్యాంగ మూలకాల యొక్క మొత్తం మోలార్ ద్రవ్యరాశి. కంపోస్టింగ్ మూలకాల యొక్క మొత్తం మోలార్ ద్రవ్యరాశి సమ్మేళనం యొక్క మోలార్ ద్రవ్యరాశి.మునుపటి దశలో, సమ్మేళనం లో ఉన్న ప్రతి మూలకం యొక్క మోలార్ ద్రవ్యరాశిని మేము లెక్కించాము, ఈ దశలో మనం ఈ విలువలను కలిపి జోడించాలి.
- హైడ్రోక్లోరిక్ ఆమ్లం యొక్క మోలార్ ద్రవ్యరాశి 1,007 + 35,453 = 36,460 గ్రా / మోల్. 36.46 గ్రాములు 1 మోల్ హైడ్రోక్లోరిక్ ఆమ్లం యొక్క ద్రవ్యరాశి.
- గ్లూకోజ్ యొక్క మోలార్ ద్రవ్యరాశి 72,0642 + 12,084 + 95,9964 = 180,1446 గ్రా / మోల్. కాబట్టి గ్లూకోజ్ యొక్క ప్రతి మోల్ 180.14 గ్రాముల ద్రవ్యరాశిని కలిగి ఉంటుంది.
సలహా
- చాలా సందర్భాలలో సగటు ద్రవ్యరాశి అణువు సమీప 1 భాగం 1000 (4 దశాంశ స్థానాలు) కు నమోదు చేయబడినప్పటికీ, ప్రయోగశాలలలో, మోలార్ ద్రవ్యరాశి తరచుగా 2 దశాంశ స్థానాలకు తగ్గించబడుతుంది, పెద్ద అణువుల కోసం కొన్నిసార్లు తక్కువ. అందువల్ల, ప్రయోగశాల విషయంలో, హైడ్రోక్లోరిక్ ఆమ్లం యొక్క మోలార్ ద్రవ్యరాశి మోల్కు 36.46 గ్రాములు, గ్లూకోజ్ 180.14 గ్రాముల చొప్పున వ్రాయవచ్చు.
నీకు కావాల్సింది ఏంటి
- రసాయన సూచన పుస్తకం లేదా మూలకాల ఆవర్తన పట్టిక
- కంప్యూటర్