రచయిత:
Lewis Jackson
సృష్టి తేదీ:
5 మే 2021
నవీకరణ తేదీ:
1 జూలై 2024

విషయము
మోల్ అనేది రసాయన శాస్త్రంలో కొలత యొక్క ప్రామాణిక యూనిట్, ఇది సమ్మేళనం లోని విభిన్న అంశాలను చూడటానికి ఉపయోగిస్తారు. సాధారణంగా సమ్మేళనం ద్రవ్యరాశిని గ్రాముల (గ్రా) లో లెక్కిస్తారు మరియు మోలార్ యూనిట్లుగా మార్చాలి. పరివర్తనం చాలా సులభం, అయినప్పటికీ, మనం అనుసరించాల్సిన కొన్ని ముఖ్యమైన దశలు ఇంకా ఉన్నాయి. దిగువ పద్ధతిని ఉపయోగించి, మీరు సులభంగా గ్రాములను మోల్స్గా మార్చవచ్చు.
దశలు
2 యొక్క 1 వ భాగం: పరమాణు ద్రవ్యరాశిని లెక్కించండి
గణిత సమస్యను పరిష్కరించడానికి అవసరమైన సామాగ్రిని సిద్ధం చేయండి. మీకు అన్ని సాధనాలు అందుబాటులో ఉన్నప్పుడు, సమస్యను పరిష్కరించడం సులభం అవుతుంది. మీకు కావలసింది:
- పెన్సిల్ మరియు కాగితం. మీరు కాగితంపై ప్రతిదీ వ్రాసినప్పుడు గణిత సులభం అవుతుంది. గరిష్ట స్కోరును చేరుకోవడానికి మీరు అన్ని దశలను ప్రదర్శించాలి.
- రసాయన మూలకాల యొక్క ఆవర్తన పట్టిక: మూలకాల యొక్క ద్రవ్యరాశి అణువులను నిర్ణయించడానికి ఉపయోగిస్తారు.
- పాకెట్ కాలిక్యులేటర్: సంక్లిష్ట సంఖ్యలను లెక్కించడానికి ఉపయోగిస్తారు.

మీరు మోలార్ యూనిట్లకు మార్చాల్సిన సమ్మేళనం ఏ మూలకాలు అని నిర్ణయించండి. పరమాణు ద్రవ్యరాశిని లెక్కించడంలో మొదటి దశ సమ్మేళనాన్ని తయారుచేసే అంశాలను నిర్ణయించడం. ఇది సులభం ఎందుకంటే మూలకాలకు సంక్షిప్తీకరణ ఒకటి నుండి రెండు అక్షరాలు మాత్రమే.- ఒక పదార్ధం రెండు అక్షరాలతో సంక్షిప్తీకరించబడితే, మొదటి అక్షరం పెద్ద అక్షరం మరియు రెండవ అక్షరం చిన్న అక్షరం. ఉదాహరణ: Mg అనేది మెగ్నీషియం మూలకం యొక్క సంక్షిప్తీకరణ.
- NaHCO సమ్మేళనాలు3 సోడియం (Na), హైడ్రోజన్ (H), కార్బన్ (C) మరియు ఆక్సిజన్ (O) అనే నాలుగు అంశాలను కలిగి ఉంటుంది.
సమ్మేళనం లోని ప్రతి మూలకానికి అణువుల సంఖ్యను నిర్ణయించండి. ఆ సమ్మేళనం యొక్క ద్రవ్యరాశి అణువును లెక్కించడానికి మీరు సమ్మేళనం లోని ప్రతి పదార్ధం యొక్క పరమాణు సంఖ్యను తెలుసుకోవాలి. మూలకం యొక్క సంక్షిప్తీకరణ పక్కన ఉన్న చిన్న సంఖ్య మూలకం యొక్క పరమాణు సంఖ్యను సూచిస్తుంది.- ఉదాహరణ: సమ్మేళనం H.2O లో రెండు హైడ్రోజన్ అణువులు మరియు ఒక ఆక్సిజన్ అణువు ఉన్నాయి.
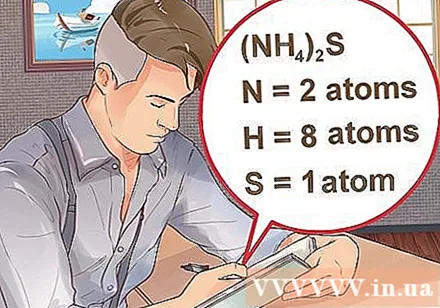
- ఒక చిన్న సూచికతో పాటు కుండలీకరణాలలో ఒక సమ్మేళనం వ్రాయబడితే, కుండలీకరణాల్లోని ప్రతి పదార్ధం సూచికను గుణిస్తుంది. ఉదాహరణ: సమ్మేళనం (NH4)2S లో రెండు N అణువులు, ఎనిమిది H అణువులు మరియు ఒక S అణువు ఉంటాయి.

ప్రతి మూలకానికి క్యూబిక్ అణు కాగితాన్ని రాయండి. ఆవర్తన పట్టికను ఉపయోగించడం అనేది ఒక మూలకం యొక్క క్యూబిక్ అణువును కనుగొనటానికి సులభమైన మార్గం. మీరు ఆవర్తన పట్టికలో మూలకాన్ని గుర్తించిన తరువాత, మూలకం యొక్క చిహ్నం క్రింద అణు ద్రవ్యరాశిని మీరు చూస్తారు.- ఉదాహరణకు, ఆక్సిజన్ యొక్క క్యూబిక్ అణువు 15.99.
పరమాణు ద్రవ్యరాశిని లెక్కించండి. ఒక పదార్ధం యొక్క ద్రవ్యరాశి అణువు ప్రతి మూలకం యొక్క అణువుల సంఖ్యకు సమానం, ఆ మూలకం యొక్క ద్రవ్యరాశి అణువుతో గుణించబడుతుంది. ఈ పరిమాణం గ్రాము నుండి మోలార్ మార్పిడికి అవసరం.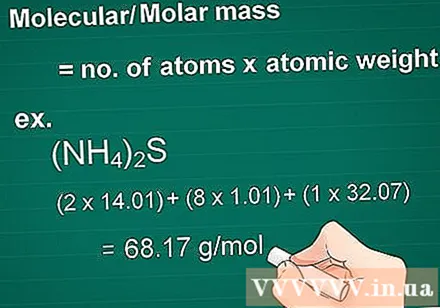
- మొదట, సమ్మేళనం లోని ప్రతి మూలకం యొక్క పరమాణు సంఖ్యను దాని ద్రవ్యరాశి అణువు ద్వారా గుణించండి.
- అప్పుడు, సమ్మేళనం లోని మూలకాల ద్రవ్యరాశిని కలపండి.
- ఉదాహరణ: సమ్మేళనం యొక్క పరమాణు ద్రవ్యరాశి (NH4)2S = (2 x 14.01) + (8 x 1.01) + (1 x 32.07) = 68.17 గ్రా / మోల్.
- పరమాణు ద్రవ్యరాశిని మోలార్ మాస్ అని కూడా అంటారు.
2 యొక్క 2 వ భాగం: గ్రాములను మోల్గా మార్చండి
మార్పిడి సూత్రాన్ని సెటప్ చేయండి. సమ్మేళనం యొక్క మోల్స్ సంఖ్యను కనుగొనడానికి, ఆ సమ్మేళనం యొక్క మోలార్ ద్రవ్యరాశి ద్వారా సమ్మేళనం యొక్క గ్రాముల సంఖ్యను విభజించండి.
- ఫార్ములా: మోల్స్ సంఖ్య = ద్రవ్యరాశి (గ్రాములు) / మోలార్ ద్రవ్యరాశి సమ్మేళనం (గ్రామ్ / మోల్)
సంఖ్యలను సూత్రంలో ప్రత్యామ్నాయం చేయండి. సరైన ఫార్ములాను సెటప్ చేసిన తరువాత, తదుపరి దశ మీరు లెక్కించిన సంఖ్యలను ఫార్ములాలో భర్తీ చేయడం. డేటా సరైన స్థితిలో ఉందని మీరు నిర్ధారించుకోవాలనుకుంటే, మీరు యూనిట్ను అణచివేయడం ద్వారా దాన్ని తనిఖీ చేయవచ్చు. సరళత తరువాత మిగిలిన యూనిట్ మోల్స్ అయితే మీరు సరిగ్గా సెట్ చేయబడతారు.
సమీకరణాన్ని పరిష్కరించండి. కాలిక్యులేటర్ ఉపయోగించి, పదార్ధం లేదా సమ్మేళనం యొక్క క్యూబిక్ అణువు ద్వారా ద్రవ్యరాశిని విభజించండి. మీరు వెతుకుతున్న పదార్ధం లేదా సమ్మేళనం యొక్క మోల్స్ సంఖ్య కొటెంట్ అవుతుంది.
- ఉదాహరణకు, సమస్య 2 గ్రా నీటికి (హెచ్2O) మరియు దానిని మోలార్ యూనిట్లుగా మార్చమని మిమ్మల్ని అడగండి. మనకు హెచ్ యొక్క మోలార్ ద్రవ్యరాశి ఉంది2O 18g / mol. 2 ను 18 ద్వారా విభజించండి, కాబట్టి మీకు 0.1111 మోల్ హెచ్ 2 ఓ ఉంది.
సలహా
- మూలకం లేదా సమ్మేళనం పేరును సమాధానాలతో చేర్చడం మర్చిపోవద్దు.
- మీరు ఒక వ్యాయామం లేదా క్విజ్ ప్రదర్శించమని అడిగితే, సమాధానాల చుట్టూ ఒక పెట్టెను ప్రదక్షిణ చేయడం లేదా గీయడం ద్వారా మీ సమాధానాలను స్పష్టంగా చూపించండి.
నీకు కావాల్సింది ఏంటి
- రసాయన ఆవర్తన పట్టిక
- పెన్సిల్
- పేపర్
- కంప్యూటర్
- కెమిస్ట్రీ సమస్యలు