రచయిత:
Judy Howell
సృష్టి తేదీ:
2 జూలై 2021
నవీకరణ తేదీ:
21 జూన్ 2024

విషయము
- అడుగు పెట్టడానికి
- 2 యొక్క 1 వ భాగం: పరమాణు సంఖ్యను కనుగొనడం
- 2 యొక్క 2 వ భాగం: సంబంధిత సమాచారాన్ని కనుగొనడం
- చిట్కాలు
ఒక మూలకం యొక్క పరమాణు సంఖ్య ఆ మూలకం యొక్క ఒకే అణువు యొక్క కేంద్రకంలో ప్రోటాన్ల సంఖ్య. ఒక మూలకం లేదా ఐసోటోప్ యొక్క పరమాణు సంఖ్య మారదు, కాబట్టి మీరు న్యూట్రాన్ల సంఖ్య వంటి మూలకం లేదా ఐసోటోప్ యొక్క ఇతర లక్షణాలను లెక్కించడానికి పరమాణు సంఖ్యను ఉపయోగించవచ్చు.
అడుగు పెట్టడానికి
2 యొక్క 1 వ భాగం: పరమాణు సంఖ్యను కనుగొనడం
 ఆవర్తన పట్టిక యొక్క కాపీని కనుగొనండి. మీ చేతిలో ఒకటి లేకపోతే మీరు ఇక్కడ ఒకదాన్ని కనుగొనవచ్చు. ప్రతి మూలకం వేరే పరమాణు సంఖ్యను కలిగి ఉంటుంది, కాబట్టి శీఘ్ర మరియు సులభమైన పద్ధతులు అందుబాటులో లేవు. మీరు ఆవర్తన పట్టిక యొక్క కాపీని కనుగొనవలసి ఉంటుంది లేదా ఒకదాన్ని గుర్తుంచుకోవాలి.
ఆవర్తన పట్టిక యొక్క కాపీని కనుగొనండి. మీ చేతిలో ఒకటి లేకపోతే మీరు ఇక్కడ ఒకదాన్ని కనుగొనవచ్చు. ప్రతి మూలకం వేరే పరమాణు సంఖ్యను కలిగి ఉంటుంది, కాబట్టి శీఘ్ర మరియు సులభమైన పద్ధతులు అందుబాటులో లేవు. మీరు ఆవర్తన పట్టిక యొక్క కాపీని కనుగొనవలసి ఉంటుంది లేదా ఒకదాన్ని గుర్తుంచుకోవాలి. - చాలా కెమిస్ట్రీ పాఠ్యపుస్తకాల్లో కవర్ లోపలి భాగంలో ముద్రించిన ఆవర్తన పట్టిక ఉంటుంది.
 మీరు చదువుతున్న మూలకాన్ని కనుగొనండి. చాలా ఆవర్తన పట్టికలలో వివిధ మూలకాల యొక్క పూర్తి పేర్లు, వాటి రసాయన చిహ్నాలు (పాదరసం కోసం Hg వంటివి) ఉంటాయి. మూలకాన్ని కనుగొనడంలో మీకు సమస్య ఉంటే, మూలకం పేరును అనుసరించి "రసాయన చిహ్నం" కోసం ఆన్లైన్లో శోధించండి.
మీరు చదువుతున్న మూలకాన్ని కనుగొనండి. చాలా ఆవర్తన పట్టికలలో వివిధ మూలకాల యొక్క పూర్తి పేర్లు, వాటి రసాయన చిహ్నాలు (పాదరసం కోసం Hg వంటివి) ఉంటాయి. మూలకాన్ని కనుగొనడంలో మీకు సమస్య ఉంటే, మూలకం పేరును అనుసరించి "రసాయన చిహ్నం" కోసం ఆన్లైన్లో శోధించండి.  పరమాణు సంఖ్యను కనుగొనండి. పరమాణు సంఖ్య సాధారణంగా మూలకం ఉన్న పెట్టె యొక్క ఎగువ ఎడమ లేదా కుడి మూలలో ఉంటుంది, అయితే ఇది పెట్టెలో మరెక్కడా ఉంటుంది. పరమాణు సంఖ్య ఎల్లప్పుడూ పూర్ణాంకం.
పరమాణు సంఖ్యను కనుగొనండి. పరమాణు సంఖ్య సాధారణంగా మూలకం ఉన్న పెట్టె యొక్క ఎగువ ఎడమ లేదా కుడి మూలలో ఉంటుంది, అయితే ఇది పెట్టెలో మరెక్కడా ఉంటుంది. పరమాణు సంఖ్య ఎల్లప్పుడూ పూర్ణాంకం. - ఇది దశాంశ సంఖ్య అయితే, మీరు బహుశా పరమాణు ద్రవ్యరాశిని చూస్తున్నారు.
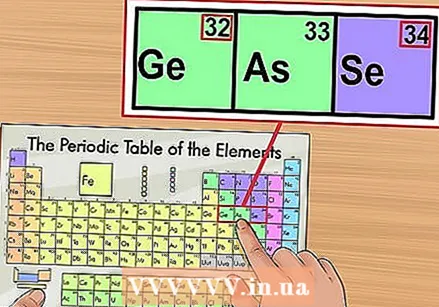 పొరుగు అంశాలకు వ్యతిరేకంగా ధృవీకరించండి. ఆవర్తన పట్టిక పరమాణు సంఖ్య ద్వారా క్రమం చేయబడుతుంది. మీ మూలకం యొక్క పరమాణు సంఖ్య "33" అయితే, ఎడమ వైపున ఉన్న మూలకం "32" మరియు కుడి వైపున ఉన్న మూలకం "34" గా ఉండాలి. ఈ ఆర్డర్ సరైనది అయితే, మీరు ఖచ్చితంగా అణు సంఖ్యను కనుగొన్నారు.
పొరుగు అంశాలకు వ్యతిరేకంగా ధృవీకరించండి. ఆవర్తన పట్టిక పరమాణు సంఖ్య ద్వారా క్రమం చేయబడుతుంది. మీ మూలకం యొక్క పరమాణు సంఖ్య "33" అయితే, ఎడమ వైపున ఉన్న మూలకం "32" మరియు కుడి వైపున ఉన్న మూలకం "34" గా ఉండాలి. ఈ ఆర్డర్ సరైనది అయితే, మీరు ఖచ్చితంగా అణు సంఖ్యను కనుగొన్నారు. - 56 (బేరియం) మరియు 88 (రేడియం) మూలకాల తర్వాత ఖాళీ స్థలం ఉండవచ్చు. వాస్తవానికి స్థలం లేదు; అణు సంఖ్యలతో ఉన్న మూలకాలు మిగిలిన వ్యవస్థ కంటే రెండు వరుసలలో ఉంటాయి. ఆవర్తన పట్టికను తక్కువ వెడల్పుగా చేయడమే అవి వేరు చేయబడిన ఏకైక కారణం.
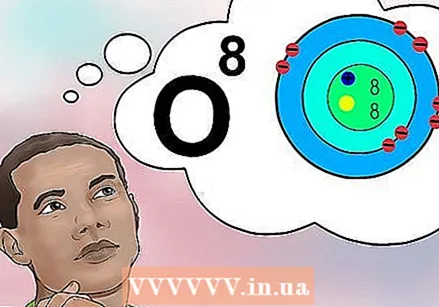 పరమాణు సంఖ్య ఏమిటో అర్థం చేసుకోండి. ఒక మూలకం యొక్క పరమాణు సంఖ్యకు ఒక సాధారణ నిర్వచనం ఉంది: ఆ మూలకం యొక్క ఒక అణువులోని ప్రోటాన్ల సంఖ్య. ఇది ఒక మూలకం యొక్క ప్రాథమిక నిర్వచనం. ప్రోటాన్ల సంఖ్య న్యూక్లియస్ యొక్క మొత్తం విద్యుత్ చార్జీని నిర్ణయిస్తుంది, ఇది ఒక అణువు ఎన్ని ఎలక్ట్రాన్లను కలిగి ఉంటుందో నిర్ణయిస్తుంది. ఎలక్ట్రాన్లు దాదాపు అన్ని రసాయన ప్రతిచర్యలకు కారణమవుతాయి కాబట్టి, పరమాణు సంఖ్య ఒక మూలకం యొక్క దాదాపు అన్ని భౌతిక మరియు రసాయన లక్షణాలను పరోక్షంగా నిర్ణయిస్తుంది.
పరమాణు సంఖ్య ఏమిటో అర్థం చేసుకోండి. ఒక మూలకం యొక్క పరమాణు సంఖ్యకు ఒక సాధారణ నిర్వచనం ఉంది: ఆ మూలకం యొక్క ఒక అణువులోని ప్రోటాన్ల సంఖ్య. ఇది ఒక మూలకం యొక్క ప్రాథమిక నిర్వచనం. ప్రోటాన్ల సంఖ్య న్యూక్లియస్ యొక్క మొత్తం విద్యుత్ చార్జీని నిర్ణయిస్తుంది, ఇది ఒక అణువు ఎన్ని ఎలక్ట్రాన్లను కలిగి ఉంటుందో నిర్ణయిస్తుంది. ఎలక్ట్రాన్లు దాదాపు అన్ని రసాయన ప్రతిచర్యలకు కారణమవుతాయి కాబట్టి, పరమాణు సంఖ్య ఒక మూలకం యొక్క దాదాపు అన్ని భౌతిక మరియు రసాయన లక్షణాలను పరోక్షంగా నిర్ణయిస్తుంది. - మరో విధంగా చెప్పాలంటే, ఎనిమిది ప్రోటాన్లు కలిగిన ప్రతి అణువు ఆక్సిజన్ అణువు. రెండు ఆక్సిజన్ అణువులకు వేరే సంఖ్యలో న్యూట్రాన్లు ఉండవచ్చు లేదా (ఒకటి అయాన్ అయితే) వేరే సంఖ్యలో ఎలక్ట్రాన్లు ఉంటాయి, కాని రెండూ ఎల్లప్పుడూ ఎనిమిది ప్రోటాన్లను కలిగి ఉంటాయి.
2 యొక్క 2 వ భాగం: సంబంధిత సమాచారాన్ని కనుగొనడం
 అణు బరువును కనుగొనడం. పరమాణు బరువు సాధారణంగా ఆవర్తన పట్టికలోని ప్రశ్న మూలకం పేరుతో ముద్రించబడుతుంది మరియు సాధారణంగా రెండు లేదా మూడు దశాంశ స్థానాలకు ఖచ్చితంగా లెక్కించబడుతుంది. మూలకం యొక్క ఒక అణువు సగటు ద్రవ్యరాశి ఇది, మీరు ప్రకృతిలో కనుగొనగలిగే వాటికి సరిపోయేలా సర్దుబాటు చేయబడింది. ఈ సంఖ్య "అణు మాస్ యూనిట్లలో" ఉంది (AMU (ఇంగ్లీష్ నుండి "అటామిక్ మాస్ యూనిట్")).
అణు బరువును కనుగొనడం. పరమాణు బరువు సాధారణంగా ఆవర్తన పట్టికలోని ప్రశ్న మూలకం పేరుతో ముద్రించబడుతుంది మరియు సాధారణంగా రెండు లేదా మూడు దశాంశ స్థానాలకు ఖచ్చితంగా లెక్కించబడుతుంది. మూలకం యొక్క ఒక అణువు సగటు ద్రవ్యరాశి ఇది, మీరు ప్రకృతిలో కనుగొనగలిగే వాటికి సరిపోయేలా సర్దుబాటు చేయబడింది. ఈ సంఖ్య "అణు మాస్ యూనిట్లలో" ఉంది (AMU (ఇంగ్లీష్ నుండి "అటామిక్ మాస్ యూనిట్")). - కొంతమంది శాస్త్రవేత్తలు "పరమాణు బరువు" కు బదులుగా "సాపేక్ష అణు ద్రవ్యరాశి" అనే పదాన్ని ఉపయోగిస్తారు.
 పరమాణు ద్రవ్యరాశిని అర్థం చేసుకోండి. అణు ద్రవ్యరాశి అణు బరువుతో సమానమైన భావన. ఒకే తేడా ఏమిటంటే, మీరు పరీక్ష నమూనా యొక్క సగటుకు బదులుగా ఒక నిర్దిష్ట అణువు గురించి మాట్లాడుతున్నారు. ఒక గ్రాము ఇనుము ఒకదానికొకటి కొద్దిగా భిన్నంగా ఉండే ద్రవ్యరాశితో చాలా అణువులను కలిగి ఉంటుంది, కాబట్టి మీరు సగటును కనుగొనడానికి "సాపేక్ష బరువు" కోసం చూస్తారు. మీరు ఒక నిర్దిష్ట ఇనుప అణువుపై మాత్రమే ఆసక్తి కలిగి ఉంటే, మీరు సగటు గురించి పట్టించుకోరు - మీరు ఆ నిర్దిష్ట అణువు యొక్క ఖచ్చితమైన ద్రవ్యరాశిపై మాత్రమే ఆసక్తి కలిగి ఉంటారు.
పరమాణు ద్రవ్యరాశిని అర్థం చేసుకోండి. అణు ద్రవ్యరాశి అణు బరువుతో సమానమైన భావన. ఒకే తేడా ఏమిటంటే, మీరు పరీక్ష నమూనా యొక్క సగటుకు బదులుగా ఒక నిర్దిష్ట అణువు గురించి మాట్లాడుతున్నారు. ఒక గ్రాము ఇనుము ఒకదానికొకటి కొద్దిగా భిన్నంగా ఉండే ద్రవ్యరాశితో చాలా అణువులను కలిగి ఉంటుంది, కాబట్టి మీరు సగటును కనుగొనడానికి "సాపేక్ష బరువు" కోసం చూస్తారు. మీరు ఒక నిర్దిష్ట ఇనుప అణువుపై మాత్రమే ఆసక్తి కలిగి ఉంటే, మీరు సగటు గురించి పట్టించుకోరు - మీరు ఆ నిర్దిష్ట అణువు యొక్క ఖచ్చితమైన ద్రవ్యరాశిపై మాత్రమే ఆసక్తి కలిగి ఉంటారు. - ఆచరణలో, అణు ద్రవ్యరాశి సాధారణంగా ఒక అణువుకు సంబంధించిన రసాయన శాస్త్ర సమస్యలకు ఇప్పటికే ఇవ్వబడుతుంది. ఈ భావనను అర్థం చేసుకోండి, తద్వారా ఇది అణు బరువుకు భిన్నంగా ఉంటే మీరు ఆశ్చర్యపోరు.
 మాస్ సంఖ్యకు రౌండ్ చేయండి. ద్రవ్యరాశి సంఖ్య ఒక మూలకం యొక్క ఒక అణువులోని మొత్తం ప్రోటాన్లు మరియు న్యూట్రాన్ల సంఖ్య. మీరు ఈ సంఖ్యను సులభంగా కనుగొనవచ్చు: ఆవర్తన పట్టికలో ఇచ్చిన అణు బరువును తీసుకొని సమీప మొత్తం సంఖ్యకు రౌండ్ చేయండి.
మాస్ సంఖ్యకు రౌండ్ చేయండి. ద్రవ్యరాశి సంఖ్య ఒక మూలకం యొక్క ఒక అణువులోని మొత్తం ప్రోటాన్లు మరియు న్యూట్రాన్ల సంఖ్య. మీరు ఈ సంఖ్యను సులభంగా కనుగొనవచ్చు: ఆవర్తన పట్టికలో ఇచ్చిన అణు బరువును తీసుకొని సమీప మొత్తం సంఖ్యకు రౌండ్ చేయండి. - ఇది పనిచేస్తుంది ఎందుకంటే న్యూట్రాన్లు మరియు ప్రోటాన్లు రెండూ 1 AMU చుట్టూ ఉంటాయి మరియు ఎలక్ట్రాన్లు 0 AMU కి దగ్గరగా ఉంటాయి. దశాంశ సంఖ్యను పొందటానికి అణు బరువు కోసం ఖచ్చితమైన కొలతలు ఉపయోగించబడతాయి, కాని ప్రోటాన్లు మరియు న్యూట్రాన్ల సంఖ్యను చెప్పే పూర్ణాంకాలపై మాత్రమే మాకు ఆసక్తి ఉంది.
- గుర్తుంచుకోండి, పరమాణు బరువును ఉపయోగించడం మీకు సాధారణ నమూనా కోసం సగటును ఇస్తుంది. ఒక బ్రోమిన్ నమూనా 80 ద్రవ్యరాశి సంఖ్యను కలిగి ఉంది, కానీ చూడగలిగినట్లుగా, ఒకే బ్రోమిన్ అణువు దాదాపు ఎల్లప్పుడూ 79 లేదా 81 మాస్ సంఖ్యను కలిగి ఉంటుంది.
 న్యూట్రాన్ల సంఖ్యను లెక్కించండి. పరమాణు సంఖ్య = ప్రోటాన్ల సంఖ్య, మరియు ద్రవ్యరాశి సంఖ్య = ప్రోటాన్ల సంఖ్య + న్యూట్రాన్ల సంఖ్య అని మీకు ఇప్పుడు తెలుసు. ఒక మూలకంలో ఎన్ని న్యూట్రాన్లు ఉన్నాయో తెలుసుకోవడానికి, మీరు పరమాణు సంఖ్యను ద్రవ్యరాశి సంఖ్య నుండి తీసివేయాలి. ఇక్కడ కొన్ని ఉదాహరణలు:
న్యూట్రాన్ల సంఖ్యను లెక్కించండి. పరమాణు సంఖ్య = ప్రోటాన్ల సంఖ్య, మరియు ద్రవ్యరాశి సంఖ్య = ప్రోటాన్ల సంఖ్య + న్యూట్రాన్ల సంఖ్య అని మీకు ఇప్పుడు తెలుసు. ఒక మూలకంలో ఎన్ని న్యూట్రాన్లు ఉన్నాయో తెలుసుకోవడానికి, మీరు పరమాణు సంఖ్యను ద్రవ్యరాశి సంఖ్య నుండి తీసివేయాలి. ఇక్కడ కొన్ని ఉదాహరణలు: - ఒకే హీలియం అణువు (అతడు) ద్రవ్యరాశి సంఖ్య 4 మరియు పరమాణు సంఖ్య 2 కలిగి ఉంటుంది. కాబట్టి, ఇది 4 - 2 = ఉండాలి 2 న్యూట్రాన్లు కలిగి.
- ఒక వెండి నమూనా (ఎగ్) ద్రవ్యరాశి సంఖ్య 108 (ఆవర్తన పట్టిక ప్రకారం) మరియు పరమాణు సంఖ్య 47 కలిగి ఉంది. సగటున, నమూనాలోని ప్రతి వెండి అణువు 108 - 47 = 61 న్యూట్రాన్లు.
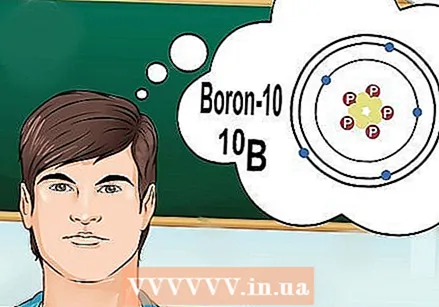 ఐసోటోపులు ఏమిటో అర్థం చేసుకోండి. ఐసోటోప్ అనేది నిర్దిష్ట సంఖ్యలో న్యూట్రాన్లతో ఒక మూలకం యొక్క నిర్దిష్ట ఆకారం. కెమిస్ట్రీ ప్రశ్న "బోరాన్ -10" లేదా "బి" ను సూచించినప్పుడు, అవి బోరాన్ యొక్క మూలకాన్ని 10 ద్రవ్యరాశి సంఖ్యతో సూచిస్తున్నాయి. "సాధారణ" బోరాన్ విలువకు బదులుగా ఈ ద్రవ్యరాశి సంఖ్యను ఉపయోగించండి.
ఐసోటోపులు ఏమిటో అర్థం చేసుకోండి. ఐసోటోప్ అనేది నిర్దిష్ట సంఖ్యలో న్యూట్రాన్లతో ఒక మూలకం యొక్క నిర్దిష్ట ఆకారం. కెమిస్ట్రీ ప్రశ్న "బోరాన్ -10" లేదా "బి" ను సూచించినప్పుడు, అవి బోరాన్ యొక్క మూలకాన్ని 10 ద్రవ్యరాశి సంఖ్యతో సూచిస్తున్నాయి. "సాధారణ" బోరాన్ విలువకు బదులుగా ఈ ద్రవ్యరాశి సంఖ్యను ఉపయోగించండి. - ఐసోటోపులకు వేరే అణు సంఖ్య లేదు. ఒక మూలకం యొక్క ప్రతి ఐసోటోప్ ఒకే సంఖ్యలో ప్రోటాన్లను కలిగి ఉంటుంది.
చిట్కాలు
- కొన్ని భారీ మూలకాలు పరమాణు బరువును కలిగి ఉంటాయి, ఇవి కుండలీకరణాలు లేదా కుండలీకరణాల్లో ఉంటాయి. దీని అర్థం పరమాణు బరువు బహుళ ఐసోటోపుల సగటు కంటే చాలా స్థిరమైన ఐసోటోప్ యొక్క ఖచ్చితమైన ద్రవ్యరాశి. (ఇది మూలకం యొక్క పరమాణు సంఖ్యపై ప్రభావం చూపదు.)